2026.1.7
本文提出一种基于高斯伪标签的弱监督学习框架,用于非造影CT中椭圆形血管结构(如腹主动脉)的分割,通过高效标注标准和新的损失函数组合显著减少了标注时间并提升了模型性能,使其在不同数据集和模型中均表现优越,并支持外部数据整合,具有广泛应用潜力。
Title题目
01
Beyond strong labels: Weakly-supervised learning based on Gaussian pseudo labels for the segmentation of ellipse-like vascular structures in non-contrast CTs
超越强标签:基于高斯伪标签的弱监督学习用于非造影CT中椭圆形血管结构的分割
文献速递介绍
02
计算机断层扫描(CT)是重要的医学成像模态。CT血管造影(CTA)通过造影剂增强血管结构与周围组织的对比度,但存在肾脏并发症、过敏反应和穿刺相关风险。非造影CT成像作为替代方案,避免了这些风险,并在腹主动脉疾病诊断和干预规划中显示出应用潜力。深度学习在医学图像分割中表现出色,但在非造影CT血管分割中面临两大挑战:一是数据标注劳动密集且耗时,需要多位专家和外科医生的监督;二是由于非造影CT血管边界模糊,导致标注准确性受影响,增加了观察者内部和观察者之间的变异性。现有的弱监督学习方法通常以牺牲模型准确性为代价来提高标注效率。为解决这一双重挑战,本文提出一种新颖的弱监督学习方法,利用CT切片中血管结构(特别是腹主动脉)的椭圆形拓扑性质,生成高斯伪标签来替代传统强标签,以期在减少标注工作量的同时保持或提高分割性能。
Aastract摘要
02
基于深度学习的血管结构自动分割在术前CT血管造影(CTA)图像中对计算机辅助诊断和干预至关重要。虽然CTA是常用标准,但非造影CT成像具有避免造影剂相关并发症的优势。然而,标注工作量大且血管边界模糊导致的标注变异性高,阻碍了传统基于强标签的全监督学习在非造影CT中的应用。本文提出一种新颖的弱监督学习框架,利用CT切片中血管结构的椭圆拓扑特性。该框架包括基于我们提出的标准的高效标注流程、生成2D高斯热图作为伪标签的方法,以及结合体素重建损失和分布损失与伪标签的训练过程。我们在一个本地数据集和两个公共非造影CT数据集(主要关注腹主动脉)上评估了所提方法的有效性。在本地数据集上,我们基于伪标签的弱监督学习方法优于基于强标签的全监督学习(Dice分数平均提高1.54%),同时将标注时间减少了约82.0%。伪标签生成的高效性使得训练集能够包含与标签无关的外部数据,从而进一步提高了性能(Dice分数平均提高2.74%),同时标注时间减少了66.3%,仍然远少于强标签的标注时间。在公共数据集上,伪标签使2D模型的Dice分数总体提高了1.95%,3D模型的Hausdorff距离减少了68%。
Method方法
03
本文提出一种基于伪标签的弱监督学习框架。与传统的强标签训练(耗时、易受观察者变异性影响,使用Dice和BCE损失)不同,本方法通过提出的标注标准高效地标注椭圆形结构,显著减少标注时间,并支持外部数据整合。标注的椭圆形结构经过椭圆拟合算法,得到五个基本参数(中心点、半长轴、半短轴和旋转角度),进而生成像素强度在[0,1]的2D高斯热图作为伪标签。在训练阶段,模型使用新颖的体素重建损失和分布损失(2D为KL散度损失,3D为Wasserstein损失)组合进行优化,以适应伪标签的特性。伪标签的生成过程分为三个步骤:1) 基于高效标注标准进行手动标注,确保封闭圆锥曲线、完整覆盖和最小可感知差异;2) 对标注的椭圆形二值掩码进行椭圆拟合以获取数值参数;3) 基于这些参数自动生成2D高斯热图。该热图作为伪标签,其中椭圆内部像素强度大于0.5,外部小于0.5。整体损失函数是分布损失和重建损失的加权组合,旨在同时拟合高斯分布和像素概率密度。
Discussion讨论
04
本文提出的基于高斯伪标签的弱监督学习方法,结合了CAMs、稀疏标签和噪声标签的特点,有效地应用于非造影CT中椭圆形血管结构(特别是腹主动脉)的分割。该方法通过高效标注标准将本地数据标注时间减少了82%,并缓解了对外科医生监督的过度依赖。尽管标注时间大幅减少,模型性能在各种度量上均显著优于强标签全监督学习模型,这归因于高斯伪标签能够反映血管结构的普遍特征,保留主动脉的拓扑性质,同时避免非造影CT扫描中边界模糊的影响。HD的降低证实了这一假设,且伪标签的观察者内部/外部一致性保证了模型训练的稳定性。标注效率的提升也促进了外部数据的引入,进一步提高了模型性能。在公共数据集TotalSegmentator上的实验结果验证了该方法的泛化能力,证实了将现有强标签转换为伪标签以提升性能的合理性。定性结果显示,伪标签在分割不规则或大型动脉瘤性主动脉横截面时表现出色,能够有效消除假阳性和假阴性,这表明高斯监督信号的一致性有助于模型更好地处理不同主动脉横截面。消融研究表明,伪标签在训练数据不足时优于强标签,这可能是因为其更好地保留了血管结构的一般特征,减轻了过拟合。随着数据集增大,强标签的过拟合问题会减弱,但高昂的标注成本成为挑战,而伪标签则在效率上更具优势。结合强弱标签的微调策略,特别是使用p{*}s作为强标签进行微调时,显著提高了敏感度,这得益于微调和预训练过程中损失函数的一致性。损失函数分析表明,本文提出的重建损失和分布损失组合对伪标签训练最为有利,并且高斯热图的平滑性、连续性和信息丰富性有助于模型更好地理解目标边界和区域。尽管本研究主要关注腹主动脉,但该方法可能需要针对不同类型的血管结构(如主动脉弓、升/降主动脉、髂动脉)进行调整,可能需要沿血管轨迹在垂直于中心线的横截面进行标注,以确保椭圆形拓扑结构。该方法有望提高非造影CT在临床应用中的竞争力,并可推广至前列腺和肾脏等其他椭圆形解剖结构的分割。
Conclusion结论
05
非造影CT中血管结构(VS)的深度学习分割面临数据标注量大以及因边界模糊导致观察者内部/外部变异性高的挑战。这些问题导致标注时间过长、过度依赖外科监督,并降低模型性能和稳定性。本文针对腹主动脉这一典型血管结构,提出了一种弱监督学习框架。该框架利用腹主动脉在CT切片中近似椭圆的拓扑形态,并生成高斯热图作为伪标签。提出的标注标准显著缩短了标注时间,而高斯热图保留了腹主动脉的内在特征,减轻了模糊边界的不利影响,从而增强了模型的稳定性和性能。在标签不可知数据集(本地数据和MSD)和已标注数据集(TotalSegmentator)上进行的实验均证明了所提方法的有效性。伪标签在标注时间和模型性能方面均优于强标签。未来的研究将把这种方法扩展到不同类型的血管结构。
Figure图
07

图1. (a) 非造影CT扫描中主动脉的常规和椭圆边界((b)和©)。两个封闭区域共享基本属性,如中心点 (x,y) 和 (x’,y’)、旋转角度 θ 和 θ’、半长轴 w 和 w’、半短轴 h 和 h’。在整个本地数据集上,这两个封闭区域的Dice系数计算结果为98.1%±0.5。由 © 生成的2D高斯分布显示在 (d) 中,其中像素强度范围为[0.0,1.0]。此高斯分布作为伪标签。
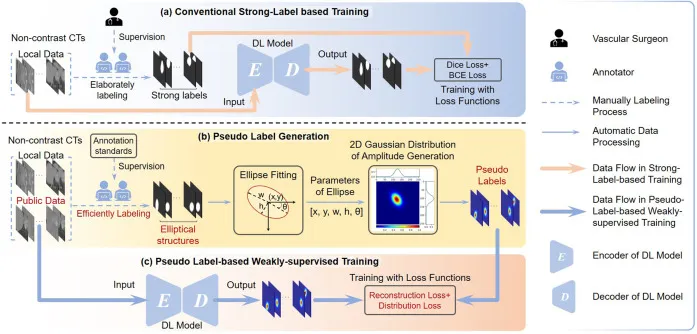
图2. (a) 强标签训练与 (b)–© 本文提出的基于伪标签的弱监督训练方法的比较。(a) 中,传统的强标签训练需要耗时、专家详细标注和血管外科医生的高度监督,使用Dice和BCE损失进行模型优化。对于本文提出的方法,(b) 展示了伪标签的生成过程。基于提出的标注标准,专家高效地标注椭圆形结构。然后,通过椭圆拟合算法处理椭圆形结构,以建立五个基本参数:中心点位置 (x,y)、半长轴 w 和半短轴 h、以及旋转角度 θ。这些参数用于创建像素强度在[0,1]范围内的2D高斯热图,其中使用一个常数来限制椭圆边界内超过0.5的强度。高斯热图作为伪标签,通过一个弱但高效的过程生成。通过标注标准和效率,可以将外部公共数据纳入以丰富训练集,而无需详尽的标注工作或外科医生的高度监督。因此,我们将 © 中的后续训练视为一种弱监督训练策略。它采用体素重建损失和分布损失的新颖组合,以适应伪标签进行模型优化。

图3. 单一专家使用ImageJ (Schneider et al., 2012) 进行的边界和二值掩码标注。样本随机选自非造影CT切片中三种类型的腹主动脉:规则形状(圆形)、不规则形状(椭圆形)和大型(含动脉瘤)主动脉。标注通过ImageJ的三种机制获得:(1) 画笔工具使用一个可拖动的小圆形画笔进行目标区域填充,(2) 徒手工具沿边界描绘,红色虚线框表示两种方法之间观察者内部的变异性,(3) 椭圆工具(本文方法采用),选择椭圆形区域。画笔工具和椭圆工具之间一系列的观察者内部变异性由红色虚线框标记。通过椭圆工具进行的标注符合提出的标注标准,表现出稳定的拓扑结构。每种工具每切片的平均标注时间显示在最后一行。
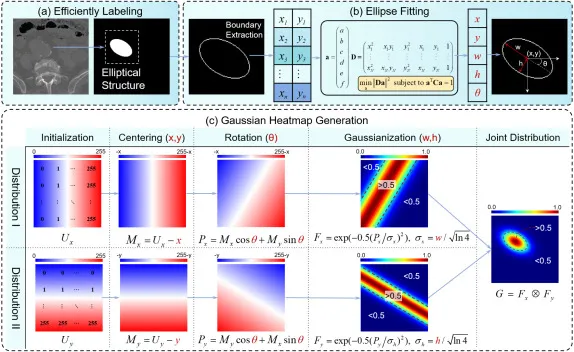
图4. 伪标签生成过程,包括 (a) 基于提出的标注标准高效标注椭圆形结构,(b) 椭圆拟合以获得数值定义椭圆的五个参数,以及 © 基于椭圆参数的2D高斯热图生成。生成的高斯热图包含[0,1]范围内的像素强度,用作弱监督学习的伪标签。请注意,只有步骤 (a) 是手动执行的,而步骤 (b) 和 © 是完全自动化的过程。
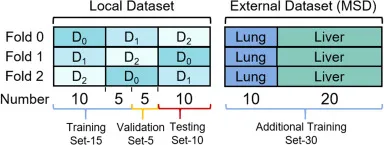
图5. 数据集用于3折交叉验证的划分。在每个折叠中,本地数据分为15个样本(卷)用于训练,5个用于验证,其余10个用于测试。有30个外部数据MSD样本,包括10个肺部和20个肝脏,作为额外的训练集。请注意,所有训练集和额外训练集都使用伪标签进行训练,而验证集和测试集的推理结果则由强标签评估。
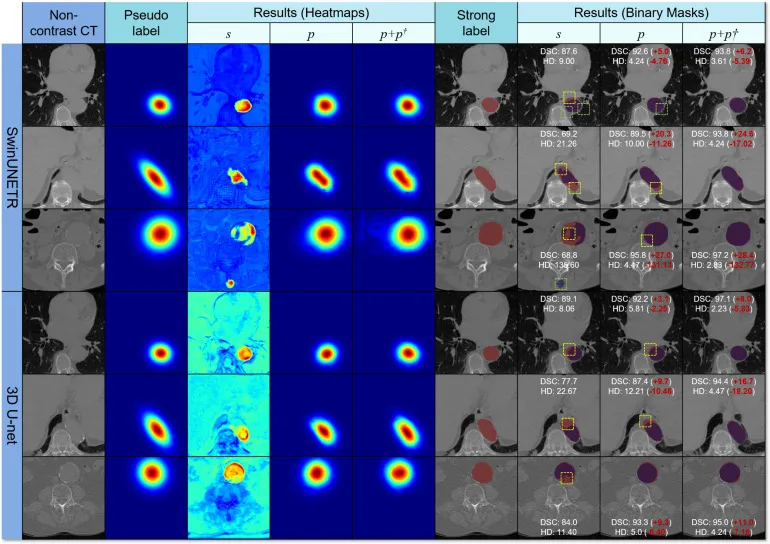
图6. 本地数据集上2D分割结果的可视化,以热图和二值掩码形式呈现,来自通过强标签(s)、伪标签(p)和包含外部数据集MSD的伪标签(p+p†)训练的2D和3D深度学习模型。在二值掩码中,红色和蓝色区域(重叠部分显示为紫色)分别代表强标签(真值)和预测结果。对于每个模型,从上到下显示了三种类型的主动脉横截面,即规则形状(圆形)、不规则形状(椭圆形)和大型(含动脉瘤)主动脉。绿色和黄色虚线框分别表示假阳性(FPs)和假阴性(FNs)。附有与每个切片相关的Dice相似系数(DSC (%))和Hausdorff距离(HD)。对于每种情况,括号中的红色数字表示与强标签对应物(s)的差异。
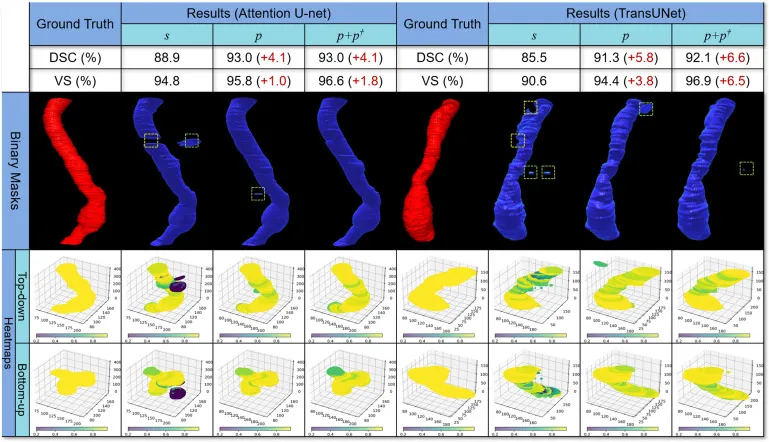
图7. 本地数据集上3D分割结果的可视化,以二值掩码和热图形式呈现,来自通过强标签(s)、伪标签(p)和包含外部数据集MSD的伪标签(p+p†)训练的Attention U-net (Oktay et al., 2018) 和TransUNet (Chen et al., 2021)。对于每个结果,顶部行显示了整个体积的Dice相似系数(DSC)和体积相似度(VS)。绿色和黄色虚线框分别表示假阳性(FPs)和假阴性(FNs)。在热图结果中,每个切片的颜色强度对应于该切片的Dice分数,颜色越浅表示Dice分数越高,颜色越深表示相关切片的Dice分数越低。热图以俯视和仰视视角显示。
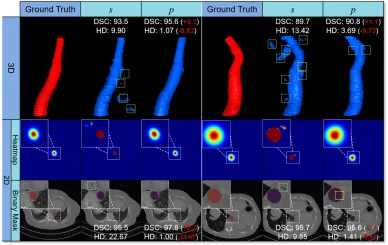
图8. TotalSegmentator上3D U-net模型通过强标签(s)和伪标签(p)训练得到的3D和2D分割结果可视化。2D结果可视化以热图和二值掩码形式显示。热图经过Sigmoid激活函数处理以突出假阳性。在二值掩码中,红色和蓝色区域(重叠部分显示为紫色)分别代表强标签(真值)和预测结果。绿色和黄色虚线框分别表示假阳性(FPs)和假阴性(FNs)。附有与每个体积或切片相关的Dice相似系数(DSC (%))和Hausdorff距离(HD)。对于每种情况,括号中的红色数字表示与强标签对应物(s)的差异。
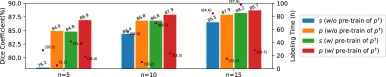
图9. SwinUNETR在训练数据量 n 和通过外部数据(含伪标签 p†)进行预训练方面的性能。左右Y坐标轴分别表示Dice分数和标注时间。条形图表示Dice分数,其上方是数值。紫色点表示与每个情况相关的标注时间,括号中显示数值。
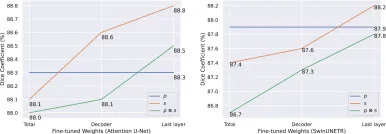
图10. 通过两种强标签(s和p⊗s)对伪标签(p)预训练模型不同部分进行微调的结果。深度学习模型为Attention U-net(左)和SwinUNETR(右)。蓝色线代表使用伪标签p进行预训练的结果,橙色线和绿色线分别代表使用标签s和p⊗s进行微调的结果。s代表原始强标签,p⊗s是p和s的逐元素乘积。x轴表示微调模型的各个部分,其中“Total”表示微调模型的所有权重,“Decoder”和“Last layer”分别表示微调模型的解码器和最后一个卷积层。
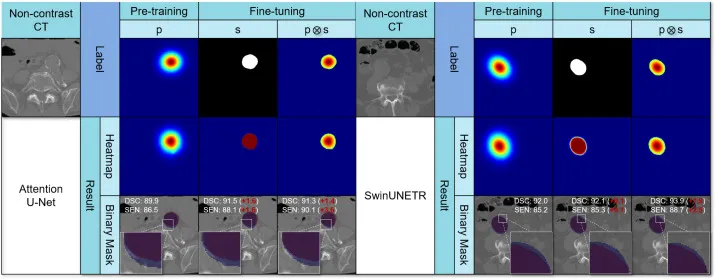
图11. 预训练和微调阶段的标签和结果可视化。“p”代表预训练的伪标签,s和p⊗s是用于微调的强标签,其中“s”表示原始强标签,“p⊗s”是p和s的逐元素乘积。附有与每个切片相关的Dice相似系数(DSC (%))和敏感度(SEN (%))。对于s和p⊗s中的每个案例,括号中的红色数字表示与预训练对应物(p)的差异。白色框被放大以获得更好的观察效果。
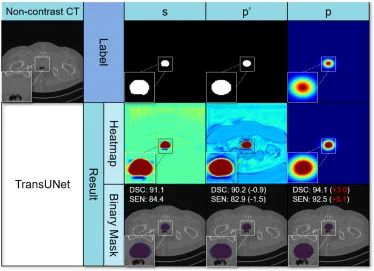
图12. TransUNet获得的前列腺标签和结果(以热图和二值掩码形式)可视化。模型通过强标签(s)、二值椭圆形结构(p’)和伪标签(p)进行训练。在二值掩码的结果中,红色和蓝色区域(重叠部分显示为紫色)分别代表强标签(真值)和预测结果。附有与每个切片相关的Dice相似系数(DSC (%))和敏感度(SEN (%))。对于p’和p中的每个案例,括号中的数字表示与s的差异,红色表示改进。切片内的方框被放大以获得更好的观察效果。
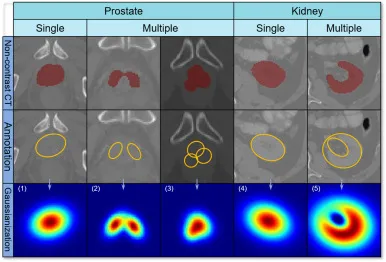
图13. 高斯伪标签在其他解剖结构中的泛化应用。第一行可视化显示了非造影CT图像和解剖结构的真值(红色)。第二行显示了使用椭圆形结构进行高效标注的方法,通过单个或多个椭圆对目标进行建模。第三行显示了生成的伪标签。单个椭圆形结构((1)和(4))按照图4(b)和©所示进行高斯化,而多个椭圆形结构则单独进行高斯化,然后通过求和((2)和(3))或求差(5)组合,再进行归一化。此过程创建了可模拟主动脉之外目标解剖结构的重叠空间高斯分布。