Title
题目
When evidence modeling meets knowledge distillation: Towards reliablecontrast-enhanced knowledge distillation for non-contrast medical imagesegmentation
当证据建模遇上知识蒸馏:迈向用于非对比医学图像分割的可靠对比增强知识蒸馏
01
文献速递介绍
对比增强知识蒸馏旨在将对比增强知识(即从对比增强医学图像中提取的知识)迁移至非对比医学图像,以用于肿瘤分析。这种方法有望改进医学诊断,并为非对比医学图像上的肿瘤分析提供创新手段(Savage,2024;Hatsutani 等,2023)。然而,现有的医学图像分割严重依赖对比增强医学图像,这不可避免地带来了临床检查中注射造影剂的弊端(Huynh 等,2020)。例如,在 MRI 检查中,基于钆的造影剂被广泛用于增强脑、肝和肾成像中正常组织与病理组织之间的信号差异(Kinno 和 Sutter,2023);而在 CT 检查中,通常使用含碘造影剂来改善血管和组织的可视化效果,有助于准确检测和表征病变(Zopfs 等,2021)。 对比增强成像在临床上是肿瘤分割和诊断的标准工具(Wang 等,2024;Stollmayer 等,2025)。通过增强肿瘤边界的可见性,造影剂提供了关键信息,有助于准确分割、制定治疗计划和进行手术评估(Zhao 等,2020)。这使得对比增强成像在检测肿瘤或勾勒肿瘤边界方面特别有价值。然而,注射造影剂耗时、会增加健康风险且成本更高,这限制了其在常规临床实践中的应用(Zhao 等,2021)。使用造影剂可能会导致过敏反应和肾脏并发症,特别是对于肾功能受损的患者(Marckmann 等,2006)。非对比成像为造影剂禁忌的患者提供了一种更安全的替代方案。尽管非对比成像在安全性和可及性方面具有优势,但它往往缺乏精确分割所需的对比度。因此,为了给临床诊断和治疗提供一种省时、安全且廉价的工具,人工智能造影剂生成技术受到了越来越多的关注(Savage,2024;Zhao 等,2020)。 由于造影剂注射会导致复杂的像素增强和额外噪声,对比增强知识蒸馏仍然面临挑战(Wang 等,2022b)。具体而言,造影剂通常会在肿瘤和周围组织中引入异质的强度模式,受血管动力学和成像时间的影响,这使得一致的特征表示变得复杂(Bône 等,2022)。此外,增强过程可能会引入冗余或误导性信号,导致在向非对比图像进行知识迁移时出现变异性和潜在的错位(Bône 等,2022)。如图 1(A)所示,造影剂注射带来的复杂增强在特征提取过程中容易导致肿瘤表示模糊。额外的噪声容易导致过度自信的决策。这些缺点使利用人工智能生成的对比增强知识处理非对比医学图像中的肿瘤变得复杂。这一局限性在手术规划、肿瘤监测以及资源有限环境下的护理中尤为关键,因为在这些情况下,非对比成像提供了一种更安全或更易获取的替代方案。Zhao 等(2021)如图 1(B)所示,尽管已有多项研究尝试迁移对比增强知识来指导非对比医学图像处理(Hatsutani 等,2023;Liang 等,2021;Xiao 等,2019),但这些研究仍存在局限性,没有尝试探索具有不确定性感知的对比增强知识。此外,现有的与造影剂生成相关的研究仅依赖视觉信息,忽略了医学语言中丰富的语义特征。例如,Zhang 等(2021)的研究采用了一种不确定性筛选自集成方法来探索对比增强知识迁移。然而,他们的研究仅考虑了图像信息,忽略了互补的文本数据,并且其不确定性建模仅限于基于熵的伪标签筛选,缺乏明确且可解释的不确定性量化。 证据建模和跨模态学习有望克服过度自信的决策制定和复杂的像素增强所带来的挑战。一方面,得益于文本中丰富的语义信息,跨模态学习的兴起为从文本特征中学习丰富的语义知识以理解复杂的医学图像带来了巨大机遇(Shrestha 等,2023;Zhao 等,2023)。另一方面,提高医学图像处理的可靠性(例如,在决策制定中纳入不确定性估计)在跨域医学图像数据的准确学习、确保可靠的肿瘤分析方面取得了重大进展(Gao 等,2023;Zhao 和 Li,2023)。受这些研究的启发,本研究旨在通过利用跨模态学习来增强用于复杂像素增强建模的肿瘤表示,并通过证据建模来提高像素表示的可信度,从而实现可靠的知识蒸馏,如图 1(C)所示。具体而言,在跨模态学习中,对比增强图像和非对比图像的共同文本特征表现出域一致性。嵌入从共同文本中提取的语义特征可以增强两种模态医学图像之间的域一致性。同时,证据建模通过量化预测的不确定性,能够实现可信的像素表示。最后,从对比增强域中提取证据来指导非对比域,实现了具有不确定性感知的人工智能驱动的对比增强知识迁移。 在使用现有的跨模态学习和知识蒸馏方法时,对比增强知识蒸馏仍然存在诸多局限性。当前的跨模态学习方法,如视觉语言模型(VLM),仅限于图像级别的图文匹配(Radford 等,2021),这导致空间信息丢失,并且缺乏像素感知的文本特征嵌入。此外,知识蒸馏方法依赖于通过 softmax 函数获得的 logits,这会导致过度自信,并损害对比增强知识学习的可靠性(Han 等,2022)。例如,许多基于医学 VLM 的研究已尝试用于分类(Lin 等,2023a;You 等,2023)、检测(Liu 等,2023)和分割(Liu 等,2023;Aleem 等,2024)等任务。然而,直接迁移现有的 VLM(如对比语言 - 图像预训练(CLIP,Radford 等,2021))用于医学图像分割仍然面临局限性。现有 VLM 中的图文匹配算法通常部署在全局平均图像特征上,通过乘法(Radford 等,2021)或融合模块(Liu 等,2023;Lüddecke 和 Ecker,2022)在图像级别嵌入文本特征。这种全局平均特征的使用导致空间信息丢失,而空间信息对于表示复杂的医学图像至关重要,并且在肿瘤分割等像素预测任务中造成了差距。 对于通过知识蒸馏进行的知识迁移(Gou 等,2021),现有的医学图像处理研究(Gao 等,2019;Zhai 等,2023)主要侧重于将知识蒸馏应用于各种临床应用。然而,所有这些研究都忽略了在跨域知识迁移过程中考虑跨域知识学习的可靠性(即在决策制定中纳入不确定性估计)。 在本研究中,我们提出了一种证据引导且肿瘤感知的知识蒸馏(EGTA - KD)方法,利用可靠的人工智能造影剂实现非对比医学图像上的肿瘤分割。具体而言,为了通过嵌入文本中的语义特征实现肿瘤感知跨模态学习,首先引入了上下文感知提示学习来捕捉医学文本中的上下文信息。然后,如图 1(D)所示,提出了肿瘤感知跨模态同步器(TACMS)来计算肿瘤分数图,用于匹配像素级的图像和文本特征。为了实现用于迁移对比增强知识的具有不确定性感知的人工智能造影剂蒸馏,创新的不确定性量化证据单元(UQEU)对主观逻辑内的概率分布进行参数化,以收集对比增强知识的可靠证据,同时量化预测的不确定性。最后,新设计的双层次知识蒸馏(DLKD)通过最小化肿瘤分数图误差和使用 Kullback - Leibler 散度匹配证据分布,确保非对比域的不确定性量化概率与对比增强域的概率一致,从而实现可靠的造影剂蒸馏。 本研究使用成对的对比增强和非对比医学图像(标注有肿瘤分割标签)来促进跨域知识迁移。用于验证的数据集,如 BraTS 2021 脑 MRI 数据集(1251 名受试者)、肝脏 MRI 数据集(238 名受试者)和肾脏 CT 数据集(113 名受试者),将在 4.1 节详细介绍。 本研究的贡献总结如下: 1. 首次提出了一种新颖的证据引导知识蒸馏框架 EGTA - KD,用于对对比增强知识的证据进行建模以进行蒸馏,为非对比医学图像上的肿瘤分割提供了可靠工具。 2. 所提出的 UQEU 采用狄利克雷分布和登普斯特 - 沙菲理论对主观逻辑内的概率分布进行参数化。它量化不确定性信息,用于具有不确定性感知的对比增强知识建模。 3. 创新的 TACMS 利用定制的矩阵运算来计算像素级肿瘤分数图,用于肿瘤感知跨模态学习,弥合了医学图像分析中文本与图像融合之间的差距。 4. DLKD 利用 Kullback - Leibler 散度最小化肿瘤分数图误差并匹配证据分布,确保非对比域的不确定性量化概率与对比增强域的概率一致,从而实现可靠的造影剂蒸馏。
Abatract
摘要
Contrast-enhanced knowledge distillation promises to transform medical diagnostics and reveal promisingapproaches for tumor segmentation on non-contrast medical images. However, existing methods related tocontrast-enhanced knowledge distillation still make it hard to distill reliable contrast-enhanced knowledgefor tumor segmentation due to the limitations of (1) unable to quantify uncertainty information for reliablecontrast-enhanced and non-contrast knowledge modeling, which leads to an over-confidence cross-domainadaptation for transferring contrast-enhanced knowledge; (2) using vision information only ignores richsemantic features in medical language, which make it hard to model complex tumor enhancement feature. Inthis study, we propose an evidence-guided and tumor-aware knowledge distillation (EGTA-KD) for transferringcontrast-enhanced domain knowledge to non-contrast domain knowledge. Specifically, to achieve tumorawareness by embedding semantic features from text, the tumor-aware cross-modal synchronizer (TACMS)is proposed to calculate tumor score maps for matching pixel wise image and text features. To achievereliable cross-domain modeling for transferring contrast-enhanced knowledge, the innovative uncertaintyquantified evidence unit (UQEU) parameterizes the probability distribution within subjective logic to gatherreliable evidence of contrast-enhanced knowledge while quantifying the uncertainty of prediction. Lastly, newlydesigned dual-level knowledge distillation (DLKD) minimizes tumor score map errors and matches evidencedistribution for uncertainty-aware contrast-enhanced knowledge distillation. Extensive experiments of tumorsegmentation on non-contrast medical images are performed using multi-modality medical image datasets(i.e., Brain MRI dataset, Liver MRI dataset, and Kidney CT dataset). Experimental results demonstrate theproposed EGTA-KD outperforms the other compared state-of-the-art methods, revealing its superiority of tumorsegmentation on non-contrast medical images via uncertainty-aware contrast-enhanced knowledge distillation.
对比增强知识蒸馏有望改变医学诊断,并为非对比医学图像上的肿瘤分割提供有前景的方法。然而,现有的与对比增强知识蒸馏相关的方法仍难以提炼出可靠的对比增强知识用于肿瘤分割,原因在于其存在以下局限性:(1)无法量化不确定性信息以进行可靠的对比增强和非对比知识建模,这导致在迁移对比增强知识时出现过度自信的跨域适配;(2)仅使用视觉信息会忽略医学语言中丰富的语义特征,使得难以对复杂的肿瘤增强特征进行建模。在本研究中,我们提出了一种证据引导且肿瘤感知的知识蒸馏(EGTA-KD)方法,用于将对比增强域知识迁移至非对比域知识。具体而言,为了通过嵌入文本中的语义特征实现肿瘤感知,我们提出了肿瘤感知跨模态同步器(TACMS),以计算肿瘤分数图,用于匹配像素级的图像和文本特征。为了实现可靠的跨域建模以迁移对比增强知识,创新的不确定性量化证据单元(UQEU)对主观逻辑内的概率分布进行参数化,从而收集对比增强知识的可靠证据,同时量化预测的不确定性。最后,新设计的双层次知识蒸馏(DLKD)最小化肿瘤分数图误差,并匹配证据分布,以实现具有不确定性感知的对比增强知识蒸馏。我们利用多模态医学图像数据集(即脑部MRI数据集、肝脏MRI数据集和肾脏CT数据集),在非对比医学图像上进行了大量的肿瘤分割实验。实验结果表明,所提出的EGTA-KD方法优于其他对比的最先进方法,通过具有不确定性感知的对比增强知识蒸馏,展现了其在非对比医学图像肿瘤分割任务中的优越性。
Method
方法
3.1. Overview
EGTA-KD is a comprehensive framework designed for reliablecontrast-enhanced knowledge distillation. It transfers domain knowledge from contrast-enhanced to non-contrast medical images usingevidence modeling to address predictive uncertainty. This approach incorporates cross-modal interaction mechanisms and employs Dirichletdistributions to represent evidence, facilitating effective knowledge distillation while quantifying uncertainty for improved segmentation. Fig.2 illustrates the overall workflow of the proposed EGTA-KD framework,showcasing its key modules (tumor-aware cross-modal synchronizer(TACMS), uncertainty-quantified evidence unit (UQEU),
3.1. 概述 EGTA-KD是一个旨在实现可靠对比增强知识蒸馏的综合框架。它利用证据建模来处理预测不确定性,将对比增强医学图像的域知识迁移至非对比医学图像。该方法融入了跨模态交互机制,并采用狄利克雷分布来表示证据,在量化不确定性以提升分割效果的同时,促进高效的知识蒸馏。图2展示了所提出的EGTA-KD框架的整体工作流程,其中重点呈现了其核心模块(肿瘤感知跨模态同步器TACMS、不确定性量化证据单元UQEU)。
Conclusion
结论
The proposed EGTA-KD provides a novel knowledge distillationframework with evidence modeling and cross-modal learning for noncontrast medical image segmentation. The innovative TACMS introduces tumor score maps for tumor-aware cross-modal learning, achieving pixel-wise text feature embedding while incorporating sufficientspatial information from images. The DLKD distills contrast-enhancedknowledge from the contrast-enhanced to the non-contrast domainsby minimizing tumor score map errors and matching evidence distribution. Additionally, the proposed UQEU quantifies the uncertaintyof contrast-enhanced features to gather reliable evidence in the tumor region, marking the first time the reliability of contrast-enhancedknowledge has been considered in AI contrast agent generation. Furthermore, context-aware prompt learning captures contextual information in diverse medical prompts, enhancing the extraction and robustness of medical prompt features. Ablation studies indicated that eachcomponent in our EGTA-KD contributes to tumor segmentation on noncontrast medical images. Extensive experimental results demonstratedthat our proposed EGTA-KD outperforms the compared state-of-theart methods in non-contrast medical image segmentation. Therefore,EGTA-KD provides a reliable tool for contrast-enhanced knowledgedistillation, having great potential to provide a contrast agent-freemethod with safe, time-saving, and cost-effective advantages for tumorsegmentation.
本文提出的EGTA-KD(证据引导与肿瘤感知知识蒸馏)是一种新颖的知识蒸馏框架,融合了证据建模与跨模态学习,适用于非对比医学图像分割任务。创新性的TACMS(肿瘤感知跨模态同步器)引入肿瘤分数图以实现肿瘤感知的跨模态学习,在实现像素级文本特征嵌入的同时,还整合了来自图像的充足空间信息。DLKD(双层次知识蒸馏)通过最小化肿瘤分数图误差和匹配证据分布,将对比增强域的对比增强知识蒸馏到非对比域。此外,所提出的UQEU(不确定性量化证据单元)对对比增强特征的不确定性进行量化,以收集肿瘤区域的可靠证据,这是首次在AI造影剂生成中考虑对比增强知识的可靠性。再者,上下文感知提示学习能够捕捉不同医学提示中的上下文信息,提升医学提示特征的提取效果和稳健性。消融实验表明,EGTA-KD中的每个组件都对非对比医学图像的肿瘤分割有所贡献。大量实验结果显示,本文提出的EGTA-KD在非对比医学图像分割方面优于同类先进方法。因此,EGTA-KD为对比增强知识蒸馏提供了一种可靠工具,极有可能成为一种无需造影剂的肿瘤分割方法,具备安全、省时、经济高效等优势。
Results
结果
The EGTA-KD is validated in the brain, liver, and kidney tumorsegmentation on non-contrast medical images. The visual segmentationresults are shown in Fig. 6 and the quantitative analysis results ofDSC and HD95 are shown in Tables 2 and 3, respectively. Experimental results indicate that EGTA-KD accurately segments tumors, whichachieves an average DSC value of 0.908 for brain tumor segmentation,an average DSC value of 0.905 for liver tumor segmentation, and a DSCvalue of 0.763 for kidney tumor segmentation. For HD95 evaluationcriteria, EGTA-KD achieves an average HD95 value of 6.23 mm forbrain tumor segmentation, an average HD95 value of 3.52 mm for livertumor segmentation, and an HD95 value of 3.05 mm for kidney tumorsegmentation.
EGTA-KD在非对比医学图像的脑、肝、肾肿瘤分割任务中得到了验证。视觉分割结果如图6所示,DSC( dice相似系数)和HD95(95%豪斯多夫距离)的定量分析结果分别如表2和表3所示。实验结果表明,EGTA-KD能够准确分割肿瘤,在脑肿瘤分割中平均DSC值达到0.908,肝肿瘤分割平均DSC值为0.905,肾肿瘤分割DSC值为0.763。在HD95评价标准下,EGTA-KD在脑肿瘤分割中的平均HD95值为6.23毫米,肝肿瘤分割平均HD95值为3.52毫米,肾肿瘤分割HD95值为3.05毫米。
Figure
图
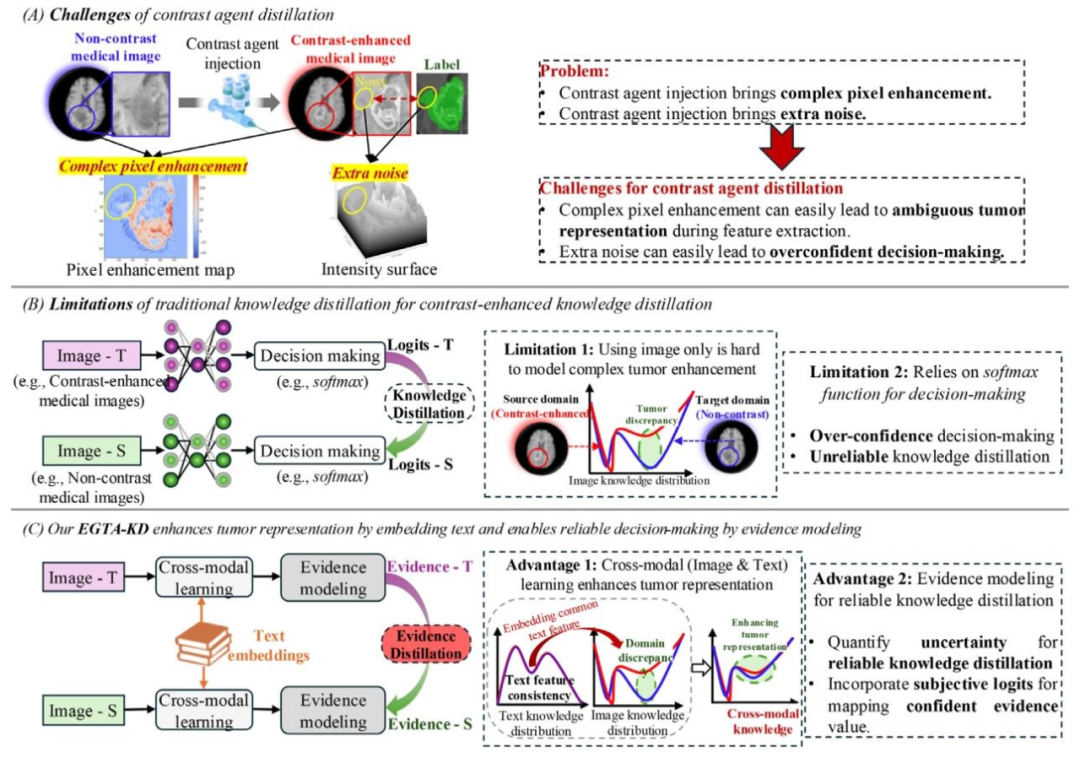
Fig. 1. Overview of the significance of reliable contrast-enhanced knowledge distillation. (A) Challenges of contrast-enhanced knowledge distillation, (B) Limitations of existingknowledge distillation framework for contrast-enhanced knowledge distillation, and © Advantages of our proposed EGTA-KD.
图1. 可靠的对比增强知识蒸馏的重要性概述。(A)对比增强知识蒸馏面临的挑战,(B)现有知识蒸馏框架在对比增强知识蒸馏中的局限性,(C)我们提出的EGTA-KD的优势。
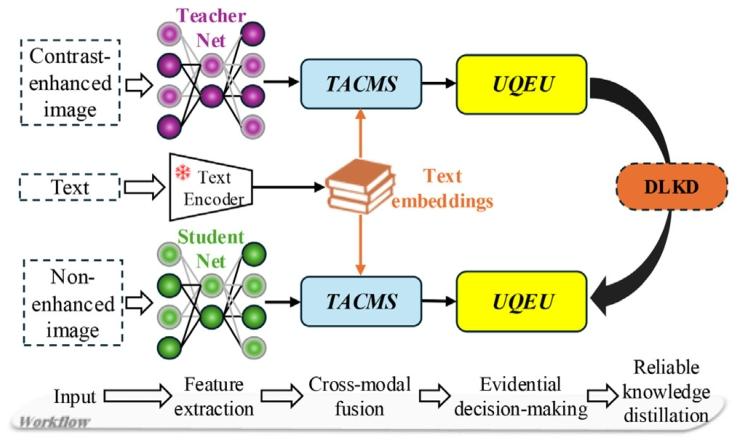
Fig. 2. The simplified workflow of EGTA-KD presents the relationship betweenTeacher-Net, Student-Net, and the core modules (TACMS, UQEU, and DLKD).
图2. EGTA-KD的简化工作流程展示了教师网络(Teacher-Net)、学生网络(Student-Net)与核心模块(肿瘤感知跨模态同步器TACMS、不确定性量化证据单元UQEU、双层次知识蒸馏DLKD)之间的关系。
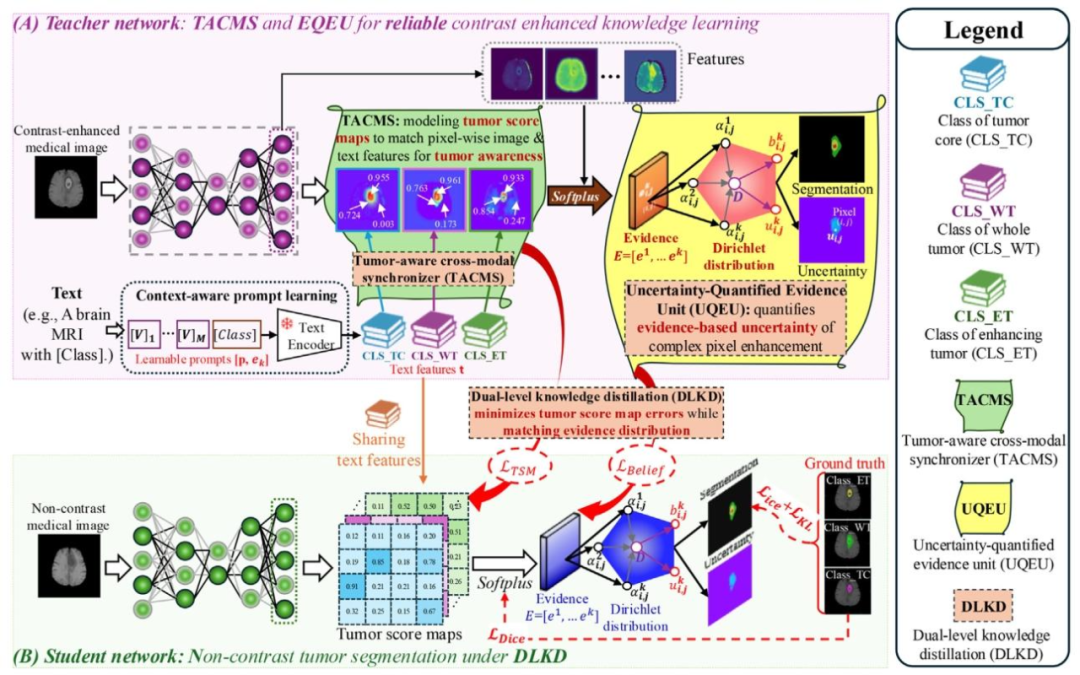
Fig. 3. Overview of our proposed EGTA-KD. It mainly contains three innovative parts for reliable contrast-enhanced knowledge distillation: TACMS for tumor-aware cross-modallearning, UQEU for reliable contrast-enhanced knowledge modeling with uncertainty quantification, and DLKD for reliable contrast agent distillation at both tumor score map andevidence level.
图3. 我们提出的EGTA-KD框架概述。为实现可靠的对比增强知识蒸馏,该框架主要包含三个创新部分:用于肿瘤感知跨模态学习的TACMS、用于带不确定性量化的可靠对比增强知识建模的UQEU,以及用于在肿瘤分数图和证据层面实现可靠造影剂蒸馏的DLKD。
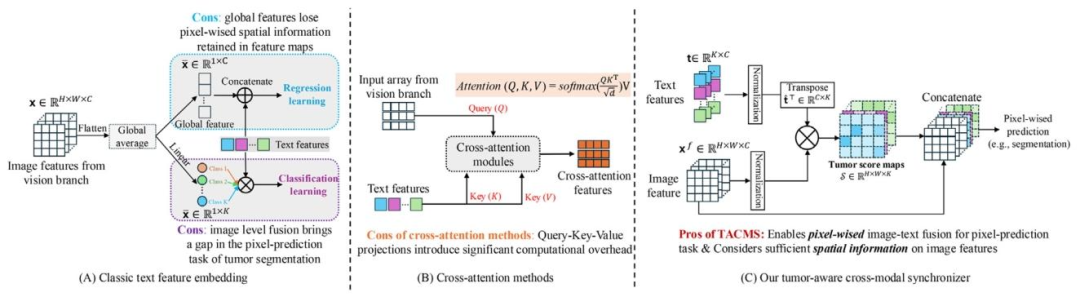
Fig. 4. Algorithm comparison: classic text feature embedding, cross-attention, and proposed TACMS. (A) Classic text feature embedding performs global image-level fusion ordirect concatenation, which loses spatial information critical for segmentation. (B) Cross-attention mechanisms align features through query–key–value projections but introducesignificant computational overhead. © The proposed TACMS generates tumor score maps, preserving rich spatial details and enabling pixel-level text embedding tailored formedical image segmentation tasks.
图4. 算法对比:经典文本特征嵌入、交叉注意力机制与所提出的TACMS。(A)经典文本特征嵌入采用全局图像级融合或直接拼接,丢失了对分割至关重要的空间信息。(B)交叉注意力机制通过查询-键-值投影进行特征对齐,但会带来显著的计算开销。(C)所提出的TACMS生成肿瘤分数图,保留丰富的空间细节,并实现为医学图像分割任务量身定制的像素级文本嵌入。
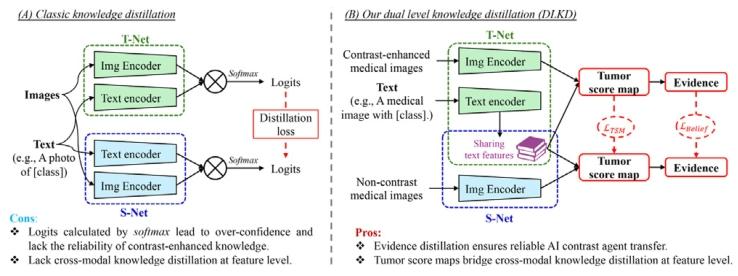
Fig. 5. Algorithm comparison between classic knowledge distillation in vision languagemodel and our DLKD. (A) The knowledge distillation in the classic method is performedbetween independent T-Net and S-Net on the response level. (B) Our DLKD concernsthe feature level distillation using tumor score map and the response level distillationusing evidence. Moreover, to further improve distillation and reduce computation, wereuse the common text features corresponding to the paired contrast-enhanced medicalimages and non-contrast medical images.
图5. 视觉语言模型中的经典知识蒸馏与我们提出的DLKD的算法对比。(A)经典方法中的知识蒸馏在响应层面于独立的教师网络(T-Net)和学生网络(S-Net)之间进行。(B)我们的DLKD既涉及利用肿瘤分数图的特征层面蒸馏,也包括利用证据的响应层面蒸馏。此外,为进一步改进蒸馏效果并减少计算量,我们复用了与成对的对比增强医学图像和非对比医学图像相对应的共同文本特征。
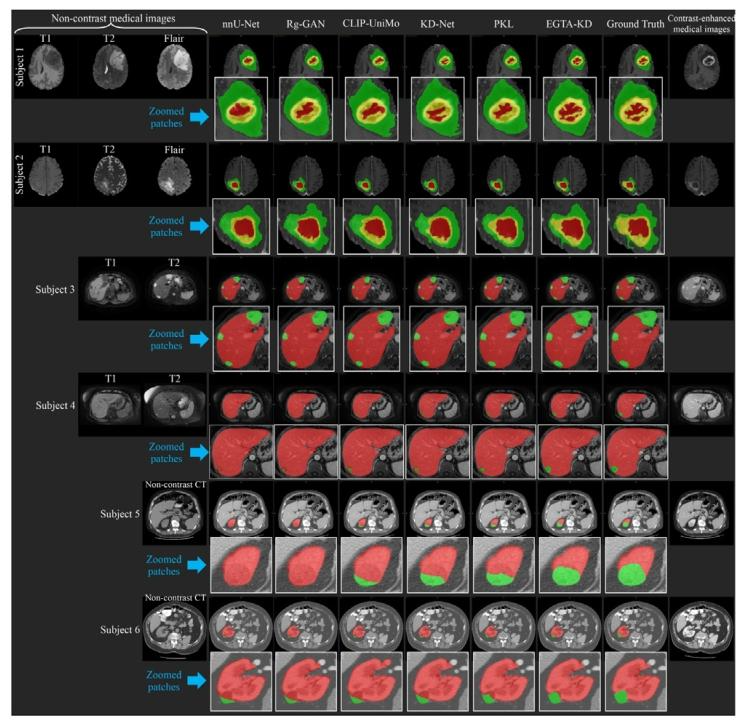
Fig. 6. The visual examples for tumor segmentation on non-contrast medical images.Subject 1 and subject 2 are brain tumor segmentation on multi-modality non-contrastmedical images of T1, T2, and Flair. Subject 3 and subject 4 are liver tumorsegmentation on non-contrast medical images of T1 and T2. Subject 5 and subject6 are kidney tumor segmentation on non-contrast CT. Where the zoomed local patchesare the brain tumor region, liver region, and kidney region on these three types ofsubjects. Our EGTA-KD gains the best overlap with ground truth among these comparedmethods.
图6. 非对比医学图像上肿瘤分割的可视化示例。受试者1和受试者2为多模态非对比医学图像(T1、T2和Flair序列)上的脑肿瘤分割。受试者3和受试者4为非对比医学图像(T1和T2序列)上的肝肿瘤分割。受试者5和受试者6为非对比CT上的肾肿瘤分割。其中,放大的局部区域分别是这三类受试者的脑肿瘤区域、肝脏区域和肾脏区域。在这些对比方法中,我们的EGTA-KD与真实标签的重叠度最高。
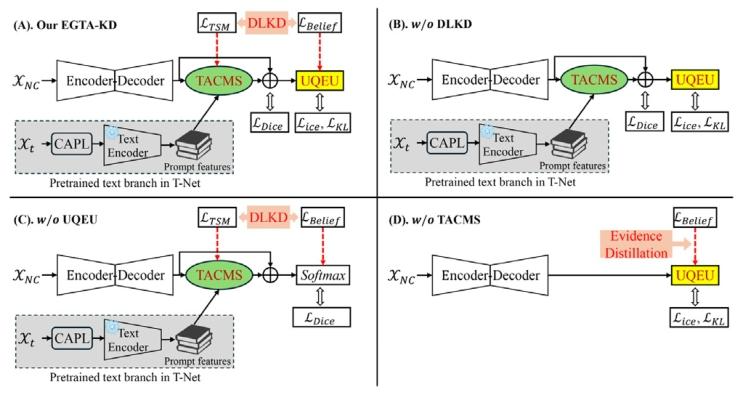
Fig. 7. Structures of the (A) our proposed EGTA-KD, (B) EGTA-KD without DLKD, ©EGTA-KD without UQEU, and (D) EGTA-KD without TACMS.
图7. 以下为各框架结构示意图:(A)我们提出的EGTA-KD;(B)不含双层次知识蒸馏(DLKD)的EGTA-KD;(C)不含不确定性量化证据单元(UQEU)的EGTA-KD;(D)不含肿瘤感知跨模态同步器(TACMS)的EGTA-KD。

Fig. 8. Salient maps were obtained by our EGTA-KD and ablation study frameworks of𝑤∕𝑜* DLKD, 𝑤∕𝑜 UQEU, and 𝑤∕𝑜 TACMS. Salient maps provide intuitive visualization forevaluating the contribution of DLKD, UQEU, and TACMS. Meanwhile, it also providesa confidence evaluation of tumor segmentation.
图8. 显著图由我们的EGTA-KD及去除DLKD(w/o DLKD)、去除UQEU(w/o UQEU)、去除TACMS(w/o TACMS)的消融实验框架得到。显著图为评估DLKD、UQEU和TACMS的贡献提供了直观的可视化方式,同时也为肿瘤分割的置信度评估提供了依据。
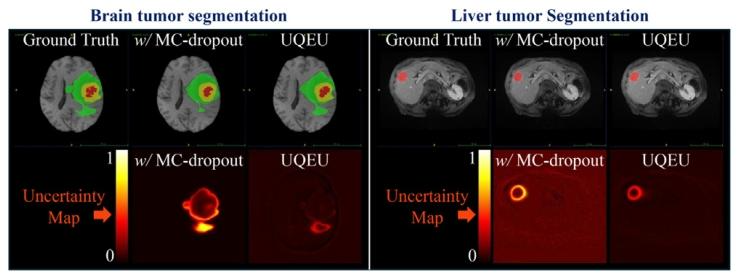
Fig. 9. Segmentation results with uncertainty estimation were obtained by using thecompared method of MC-dropout and our UQUE. Our UQEU outperforms MC-dropoutfor tumor segmentation and uncertainty estimation.
图9. 分割结果及不确定性估计由对比方法MC-dropout和我们的UQEU得到。在肿瘤分割和不确定性估计方面,我们的UQEU性能优于MC-dropout。
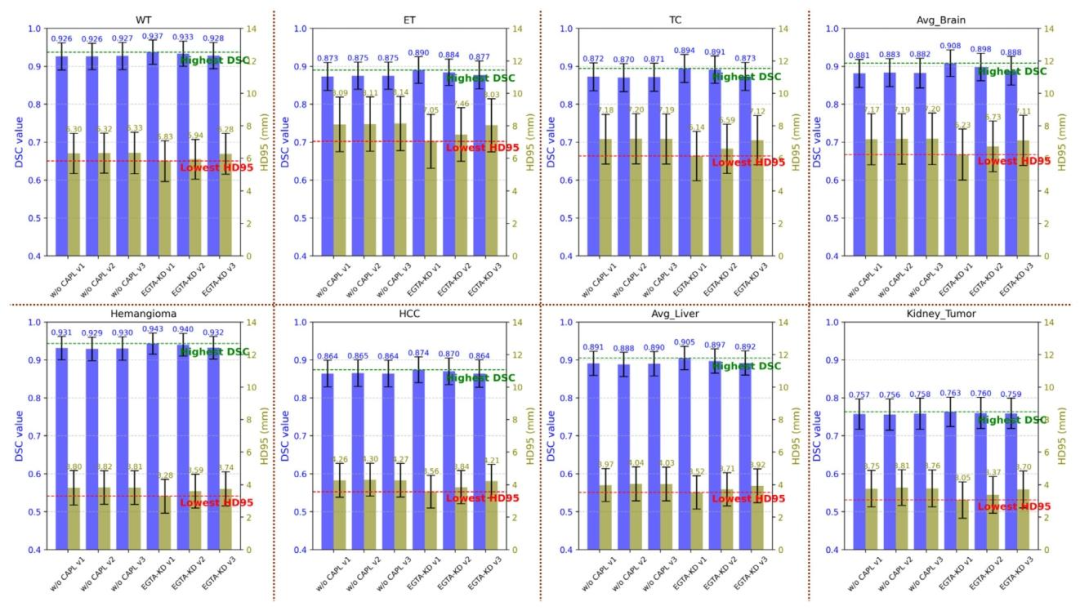
Fig. 10. Performance comparison for ablation study of context-aware prompt learning among three different medical prompt templates. This figure presents a comparative analysisof the DSC and HD95 metrics across eight tumor classes. The top row illustrates results for brain MRI tumors (WT, ET, TC, Avg𝐵𝑟𝑎𝑖𝑛), while the bottom row shows results for liverand kidney tumors (hemangioma, HCC, Avg𝐿𝑖𝑣𝑒𝑟 , kidney tumor). The left 𝑦-axis (blue) represents DSC values, and the right 𝑦-axis (olive) represents HD95 values in millimeters. Bluebars ( ) indicate DSC values, and olive bars ( ) indicate HD95 values, both accompanied by error bars to show standard deviations. Each subplot highlights the highest DSCwith a green dashed line (- - -) labeled ‘‘Highest DSC’’ and the lowest HD95 with a red dashed line (- - -) labeled ‘‘Lowest HD95’’, providing a clear comparison of segmentationperformance across different methods
图10. 上下文感知提示学习在三种不同医学提示模板间的消融实验性能对比。该图展示了八大肿瘤类别的DSC和HD95指标对比分析。上排为脑部MRI肿瘤结果(WT、ET、TC、脑肿瘤平均值),下排为肝脏和肾脏肿瘤结果(血管瘤、肝细胞癌、肝脏肿瘤平均值、肾脏肿瘤)。左侧纵轴(蓝色)表示DSC值,右侧纵轴(橄榄绿)表示HD95值(单位:毫米)。蓝色柱状图( )代表DSC值,橄榄绿柱状图( )代表HD95值,均附带误差线以显示标准差。每个子图中,绿色虚线(—)标注“最高DSC”以突出最高DSC值,红色虚线(—)标注“最低HD95”以突出最低HD95值,为不同方法的分割性能提供清晰对比。
Table
表

Table 1Template-based textual data for cross-modal learning.
表1 用于跨模态学习的基于模板的文本数据。
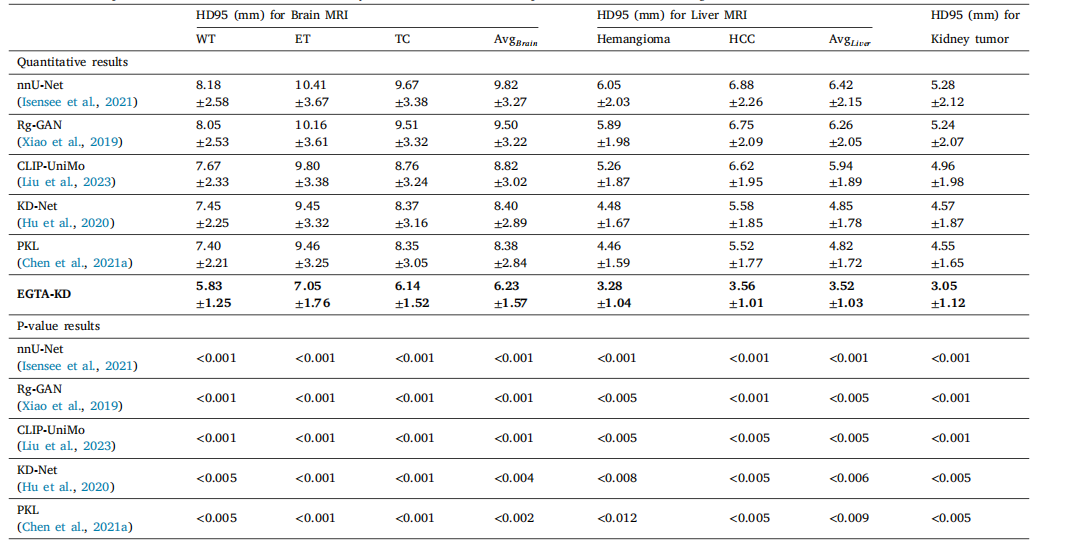
Table 2The quantitative evaluation of DSC with respect to tumor segmentation on non-contrast medical images and the paired t-test results between our EGTA-KD and other methods.The ± numbers represent the standard deviation calculated by 5-fold cross-validation. The p-values indicate statistical significance.
表2 非对比医学图像肿瘤分割的DSC定量评估结果,以及我们的EGTA-KD与其他方法之间的配对t检验结果。±后的数值表示通过5折交叉验证计算得到的标准差。p值表示统计显著性。
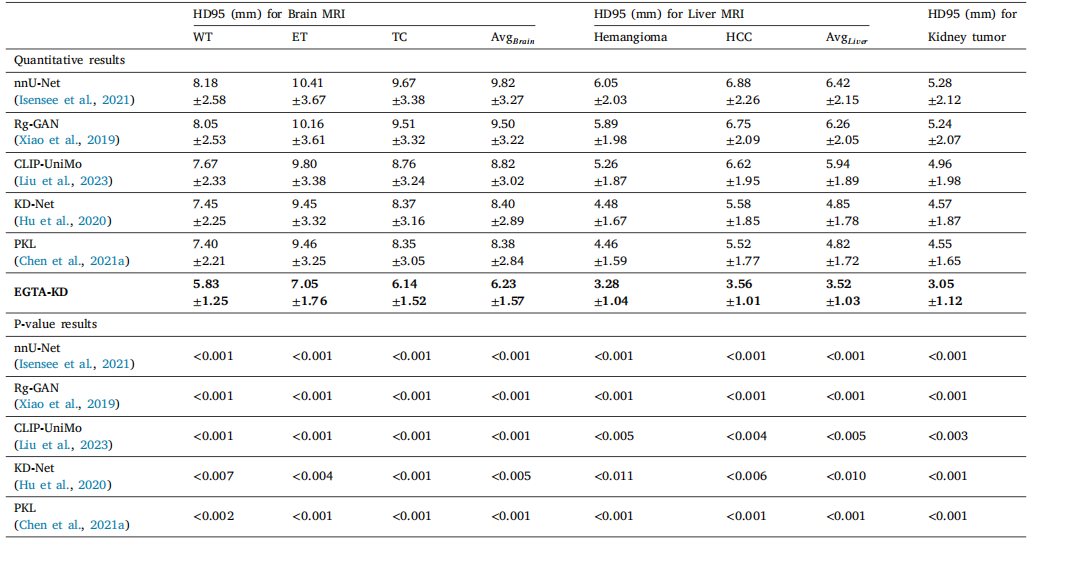
Table 3The quantitative evaluation of HD95 with respect to tumor segmentation on non-contrast medical images and the paired t-test results between our EGTA-KD and other methods.The ± numbers represent the standard deviation calculated by 5-fold cross-validation. The p-values indicate statistical significance.
表3 非对比医学图像肿瘤分割的HD95定量评估结果,以及我们的EGTA-KD与其他方法之间的配对t检验结果。±后的数值表示通过5折交叉验证计算得到的标准差。p值表示统计显著性。

Table 4The quantitative evaluation of DSC and the corresponding paired t-test results for the ablation studies in non-contrast medical image segmentation. The ± numbers represent thestandard deviation calculated by 5-fold cross-validation. The p-values indicate the statistical significance of the ablation components
表4 非对比医学图像分割中消融实验的DSC定量评估结果及相应的配对t检验结果。±后的数值表示通过5折交叉验证计算得到的标准差。p值表示消融组件的统计显著性。
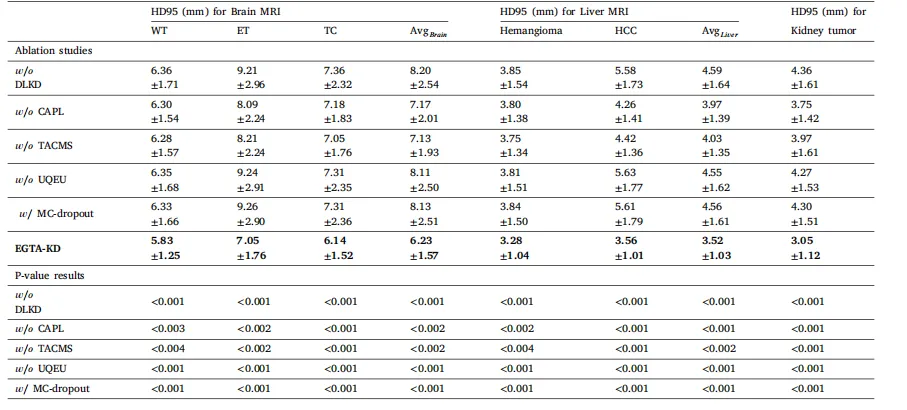
Table 5The quantitative evaluation of HD95 and the corresponding paired t-test results for the ablation studies in non-contrast medical image segmentation. The ± numbers represent thestandard deviation calculated by 5-fold cross-validation. The p-values indicate the statistical significance of the ablation components
表5 非对比医学图像分割中消融实验的HD95定量评估结果及相应的配对t检验结果。±后的数值表示通过5折交叉验证计算得到的标准差。p值表示消融组件的统计显著性。
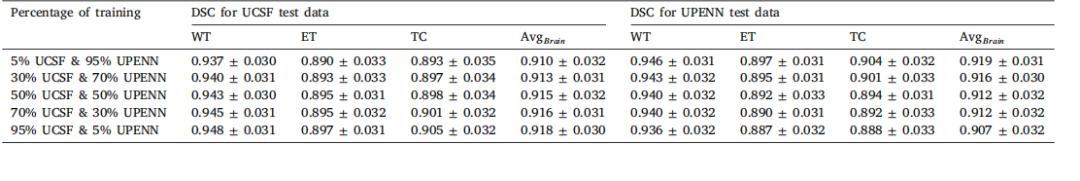
Table 6DSC metrics for UCSF and UPENN test datasets under varying training data distributions
表6 不同训练数据分布下UCSF和UPENN测试数据集的DSC指标。
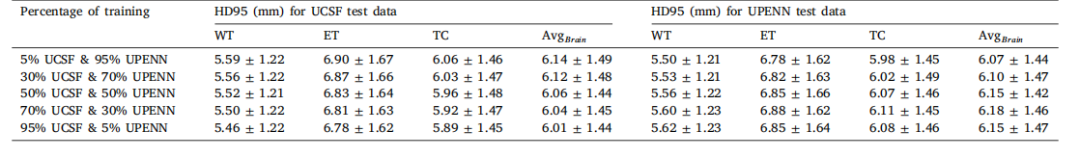
Table 7HD95 (mm) metrics for UCSF and UPENN test datasets under varying training data distributions
表7 不同训练数据分布下UCSF和UPENN测试数据集的HD95(毫米)指标。